Az elektron (az ógörög ήλεκτρον, borostyán szóból) negatív elektromos töltésű elemi részecske,[1] mely az atommaggal együtt kémiai részecskéket alkot, és felelős a kémiai kötésekért. Szokásos jelölése: e‒. Az elektron feles spinű lepton; a leptonok első generációjának tagja.[2] Antirészecskéje a pozitron.
Az elektron a legkönnyebb véges tömegű elemi részecske, tömege a proton tömegének 1/1836 része.[3] Az elektronok és a többi elemi részecske kölcsönhatását a kémia és a magfizika vizsgálja. Antianyagbeli párja, a pozitron tömege és spinje megegyezik az elektronéval, azonban töltése ellentétes. Ha pozitron és elektron találkozik, energia felvillanás során mindkettő szétsugárzódik, és gamma-foton jön létre.
Normális körülmények között az elektronok az atomok pozitív magjához kötődnek, mivel az ellentétes elektromos töltések vonzzák egymást. Egy semleges atomban az elektronok száma azonos a mag pozitív töltéseinek számával. Egy atomon belül az elektronok szabályosan elrendezett pályákon mozognak a mag körül, a mag és az elektronok közti vonzás legyőzi az elektronok közt fellépő taszító hatást. Az elektronpályák koncentrikus héjakba rendeződnek, és a magtól kifelé haladva egyre több az alhéj. A magtól való távolságtól függően a héjakban lévő elektronok kötése egyre lazább. Az elektronok elrendeződése meghatározza az atom méretét, és hatással van arra, hogy reagál más atomokra, részecskékre és az elektromágneses sugárzásra. Az ionizáció és a részecskék közötti arány megváltozása megváltoztatja a rendszer kötési energiáját. Két vagy több atom között az elektronok kicserélése vagy megosztása kémiai kötést hoz létre.[4] Fontos szerepet tölt be kémiai reakciók legnagyobb csoportjában, a redoxireakciókban.
Mivel spinje félegész szám a ħ Planck-állandóban mérve, a fermionok közé tartozik, így a Pauli-féle kizárási elv miatt két elektron nem foglalhatja el ugyanazt a kvantumállapotot.[2] Ahogy a többi anyagi részecskének, az elektronnak is van hullámtermészete; így ütközhet más részecskékkel, és megtörhet, mint a fény. Hullámtermészete egyszerűbben vizsgálható, mert kis tömege miatt a De Broglie-féle hullámhossza is magasabb a tipikus energiaszinteken.
Több fizikai jelenségben is kulcsfontosságú, így az elektromosságban, a mágnesességben, és a hővezetésben. Továbbá hat rá a többi alapvető erő: a gravitáció, az elektromágnesesség és a gyenge kölcsönhatás.[5] Negatív töltése miatt az elektron elektromos erőteret hoz létre maga körül. Egy megfigyelőhöz képest mozogva mágneses mezőt hoz létre. A külső elektromágneses terek a Lorentz-törvény szerint hatnak rá. Részt vesz a magreakciókban is, például a csillagokban zajló fúzióban, és radioaktív bomlási folyamatokban is létrejön, ahol béta-részecskeként ismert. Nagy energiájú ütközések is elektronokat hoznak létre, például a kozmikus sugarak, amikor elérik a légkört. Gyorsításkor fotonok formájában vesz fel és ad le energiát. Laboratóriumi eszközökben akár egyetlen elektron vagy elektronplazma is tartható és megfigyelhető elektromágneses mezővel. Teleszkópokkal a külső elektronplazma is megfigyelhető.
Sok alkalmazásban felhasználják, mint az elektronikában, a hegesztésben, a katódsugárcsövekben, az elektronmikroszkópokban, a sugárterápiában, a lézerekben vagy a részecskegyorsítókban.
Először Richard Laming feltételezte 1838-ban az elektromos töltés egy láthatatlan egységét, hogy megmagyarázza az atomok kémiai viselkedését.[6] George Johnstone Stoneynevezte el elektronnak ezt az elemi töltésegységet. Az elnevezés a görög elektron szóból származik, amely jelentése borostyánkő. A görögök borostyánkövet dörzsöltek meg más anyaggal, és tapasztalták az elektromos vonzó tulajdonságát. Kísérleti kimutatása 1897-ben Joseph John Thomsonnak sikerült először.[
Története[szerkesztés]
Már az ókori görögök felfedezték, hogy a borostyán vonzza az apró tárgyakat, ha bundával dörzsölik. A villámlás mellett ez az emberiség egyik legrégibb tapasztalata az elektromosságról.[19] 1600-ban az angol William Gilbert a De Magnete című értekezésében erre a jelenségre alapozva megalkotta az újlatin electricus szót.[20]
Az 1700-as évek elején Francis Hauksbee és a francia Charles François de Fay egymástól függetlenül felfedezték a dörzsölési elektromosság kétféle típusát. Az egyik az üveg, a másik a gyanta megdörzsölésével hozható létre. Du Fay elmélete szerint itt kétféle elektromos folyadék van, amelyek dörzsöléssel elválaszthatók, és semlegesítik egymást, ha összeérnek.[21] Egy évtizeddel később Benjamin Franklin szerint egyféle folyadék van, kétféle nyomással. Tőle származik a pozitív és a negatív elnevezés is.[22] Szerinte a pozitív a töltéshordozó, de nem szólt arról, hogy melyik állapotban van hiány, és melyikben fölösleg.[23]
Richard Laming angol természetfilozófus 1838 és 1851 között alkotta meg atommodelljét, amiben az atomok magból és szubatomi töltéshordozó részecskékből állnak.[24] 1846-tól a német William Weber szerint az elektromosságot pozitív és negatív folyadékok alkotják, és az inverz négyzet törvénye szerint hatnak kölcsön. Az ír George Johnstone Stoney 1874-ben tanulmányozta az elektrolízist; ez kialakította benne az elemi töltés gondolatát, ami megegyezik egy egyszeres töltésű ion töltésével. Mérései alapján meg is becsülte ezt a mennyiséget az elektrolízis Faraday-féle törvénye alapján.[25] Azonban ő azt hitte, hogy ez a töltés nem távolítható el az atomból. Hermann von Helmholtz 1881-ben amellett érvelt, hogy a pozitív és a negatív elektromosság is elemi részecskékből áll, amelyek az elektromosság atomjaiként működnek.[6]
Stoney electrolionnak nevezte az elemi töltésegységet 1881-ben. Tíz év múlva a nevet electronra változtatta. Így írt erről: Becslés készült az elektromosságnak ennek a figyelemre méltó egységnek az aktuális mennyiségéről, aminek az elektron nevet javaslom. Volt egy javaslat 1906-ban, hogy a nevet elektrolionra kell visszaváltoztatni, ám Hendrik Lorentz előnyben részesítette az elektron nevet.[26][27] A név az electric és az ion szavak kombinációjából keletkezett,[28] de azóta az elektron szóból eredeztethető -on más elemi részecskék nevének végén is megjelenik, például proton, neutron.[29][30]
Felfedezése[szerkesztés]
A német Johann Wilhelm Hittorf ritkított gázok elektromos vezetését vizsgálta. 1869-ben egy, a katódról induló izzást figyelt meg, ami annál erősebb volt, minél ritkább volt a gáz. 1876-ban a német Eugen Goldstein megmutatta, hogy ezek a sugarak árnyékot vetnek, és elnevezte őket katódsugárnak.[32] Az 1870-es években az angol Sir William Crookes előállította az első katódsugárcsövet vákuummal a belsejében.[33] Ezzel megmutatta, hogy a fénylő sugarak a katódról indulnak az anód felé, és energiát szállítanak. Ezután sikerült mágneses mezővel meghajlítani a katódsugarakat, ezzel megerősítve, hogy a sugarak negatív töltésűek.[34][35] 1879-ben kifejtette, hogy ez egy sugárzó anyaggal magyarázható. Szerinte ez az anyag negyedik halmazállapota, ami negatív töltésű összetett ionokból áll, amik nagy sebességgel vetődnek ki a katódból az anód felé.[36]
A német földön született, de az Egyesült Királyság polgárává lett Arthur Schuster folytatta Crookes kísérleteit. Két fémlapot helyezett el a katódsugarakkal párhuzamosan, és elektromos feszültséget állított elő a kettő közül. A katódsugarak a pozitív feszültségű lemez felé hajlottak el, ezzel újra megerősítették, hogy a katódsugarak negatív töltésűek. Adott erősségű áram mellett az elhajlást mérve Schuster 1890-ben megbecsülte a sugarak töltés/tömeg arányát. Mivel a kapott érték mintegy ezrese volt a vártnak, a legtöbben hibára gyanakodtak, és nem hitték el ezt az eredményt.[34][37]
1892-ben Hendrik Lorentz azt sugallta, hogy az elektronok tömege a töltésük következménye.[38]
1896-ban az angol J. J. Thomson, John S. Townsend és H. A. Wilson[8] kísérleteikből arra jutottak, hogy a katódsugarakat elemi részecskék alkotják, és nem hullámok, vagy ionok, mint ahogy korábban gondolták.[7] Thomson pontos becslést kapott mind a tömegre (m), mind a töltésre (e), ahol is a tömeg csak ezredrésze a legkönnyebb ionnak, a hidrogénnek.[7][9] Azt is megmutatta, hogy az e/m arány független a katód anyagától. Továbbá a radioaktív bomlás, a hevítés és a megvilágítás hatására is ugyanilyen részecskék lépnek ki. Az ír George F. Fitzgerald újra javasolta az elektron megnevezést, és ez elterjedt.[7][39]
A természetes fluoreszkáló ásványok tanulmányozása közben Henri Becquerel felfedezte, hogy sugárzást bocsátanak ki akkor is, ha kívülről nem nyernek energiát. Ezek a radioaktív anyagok az érdeklődés középpontjába kerültek. Ernest Rutherford felfedezte, hogy részecskéket bocsátanak ki. Ezeket alfa- és béta-részecskéknek nevezte, arra utalva, hogy képesek áthaladni az anyagon.[40] 1900-ban Becquerel a rádium béta-sugarait elektromos mezővel elhajlította, és kimutatta, hogy tömeg/töltés arányuk ugyanaz, mint a katódsugarak részecskéinek.[41] Ez erősítette azt a nézetet, hogy az elektronok az atomok részei.[42][43]
Az elektron töltését az amerikai Robert Millikan és Harvey Fletcher mérte meg pontosabban 1909-es olajcseppkísérletükben, aminek eredményeit 1911-ben publikálták. Ebben elektromos mezővel lebegtettek egy elektromosan feltöltött olajcseppet. Az eszközzel 1-150 ion töltését tudták megmérni kevesebb, mint 0,3%-os hibával. Korábban Thomson csapata is végzett hasonló kísérletet[7] az elektrolízis által feltöltött vízcseppekből álló köddel.[8]1911-ben Abram Ioffe fémek elektromosan töltött mikroporával szintén hasonló kísérletet végzett, és függetlenül Robert Millikantől és Harvey Fletchertől hasonló eredményt kapott a töltésre. Eredményeit 1913-ban publikálta.[44] Az olajcseppek alkalmasabbak erre a kísérletre, mint a vízcseppek, mert az olaj lassabban párolog, így a hosszabb ideig tartó kísérletben pontosabb eredményekhez lehet jutni.
A 20. század elején felfedezték, hogy a gyorsan mozgó részecskék bizonyos körülmények között kondenzációs csíkot húznak a túltelített vizes oldatban. 1911-ben Charles Wilson ezen az elven berendezte ködkamrát rendezett be, amiben le tudta fényképezni a részecskék nyomait, így a gyors elektronokét is.[45]
Atomelmélet[szerkesztés]
1914-ben Ernest Rutherford, Henry Moseley, James Franck és Gustav Hertz kísérletek alapján belátták, hogy az atomok kicsi, de nehéz pozitív töltésű magból és könnyű elektronokból állnak.[46] 1913-ban a dán Niels Bohr azt az elméletet javasolta, hogy az elektronok csak bizonyos energiaszinteket foglalhatnak el, ezért nem zuhannak a magba. Az ezek által meghatározott pályák között ugrálhatnak. Amikor egy magasabb szintről alacsonyabb szintre lépnek, akkor a különbség fotonként távozik. Ezzel az elmélettel sikerült megmagyaráznia a hidrogén színképét,[47] de adós maradt a nehezebb atomok spektrumával és a színképvonalak relatív fényességével.[46]
Az atomok közötti kovalens kötéseket Gilbert Newton Lewis magyarázta azzal, hogy az atomokat egy vagy több közös elektronpár tartja össze a molekulákban.[48] 1927-ben Walter Heitler és Fritz London kvantummechanikai magyarázatot adott erre.[49] 1919-ben az amerikai Irving Langmuir Lewis statikus modelljével foglalkozott, és gömbhéjakon képzelte el az elektronokat,[50] ahol egy héjon egy elektronpár osztozik. Ezzel a modellel Langmuir meg tudta magyarázni az összes elem kémiai tulajdonságait a periódusos rendszerben.[49] Ezek főbb jellemzőikben periódusosan viselkednek.[51]
1924-ben az osztrák Wolfgang Pauli négy paraméterrel írta le az atom héjszerkezetét, amiben minden elektron más állapotot foglal el. Ezt ma Pauli-féle kizárási elvkéntismerik.[52] Az utolsó paraméternek két állapota van. Ennek fizikai mechanizmusát a holland Samuel Goudsmit és George Uhlenbeck magyarázta. 1925-ben azzal álltak elő, hogy a pálya szögnyomatéka mellett belső szögmomentumuk és mágneses dipólmomentumuk is van.[46][53] Azóta ezt az elektron spinjének nevezik. Ez magyarázza a színképvonalak misztikus hasadását, ami nagy felbontású spektrográffal figyelhető meg. Ez a finomszerkezeti hasadás.[54]
Kvantummechanika[szerkesztés]
1924-ben kiadott értekezésében a francia Louis de Broglie azt az elméletét írta le, hogy minden anyagnak van hulláma is, a fényhezhasonlóan.[55] Így bizonyos körülmények között az egyes anyagi részecskék hullámként is viselkedhetnek. Részecskeként van helye, pályája és sebessége.[56] A hullámtermészet megfigyelhető, ha átbocsátják réseken, és interferál önmagával. 1927-ben George Paget Thomson elvégezte a kísérletet. Az interferáció mintája vékony fémszalagon képeződött le. Clinton Davisson és Lester Germer amerikai fizikusok nikkelkristályt használtak.[57]
A hullámtermészet arra ösztönözte Erwin Schrödingert, hogy hullámegyenletet állítson fel a mag vonzása alatt álló elektronról. 1926-ban egyenleteivel az is le tudta írni, hogyan haladnak az elektronhullámok.[58] Ahelyett, hogy az elektron pillanatnyi helyét számította volna ki, valószínűséget adott az elektron előfordulására. Ez a megközelítés vezetett Heisenberg után a második kvantummechanikai képlethez. Ennek megoldásai Heisenberg egyenleteihez hasonlóan megadták az elektron energiaszintjét is a hidrogénatomban, ami Bohr egyenleteinek megfelelően reprodukálta a hidrogén spektrumát.[59] Több elektron kölcsönhatását és spinjét tekintetbe véve a kvantummechanika képessé vált arra, hogy a magasabb rendszámú atomokban is megadja az elektronok konfigurációját.[60]
1928-ban Wolfgang Pauli munkájára alapozva Paul Dirac egy új egyenlettel állt elő, ami az elektron egy modelljét írja le. A Dirac-egyenletkonzisztens a relativitáselmélettel, relativisztikus és szimmetria meggondolásokat alkalmaz az elektromágneses mező kvantummechanikájának Hamilton-képleteire.[61] Volt néhány probléma a relativisztikus egyenlettel, ezért Dirac a vákuumot úgy modellezte, mint ami tele van negatív energiájú részecskék végtelen sokaságával. Ezt Dirac-tengernek nevezték. Ez elvezette őt az elektron antirészecskéjéhez, a pozitronhoz.[62] A részecskét 1932-ben Carl Anderson fedezte fel, aki azt javasolta, hogy az elektront negatronnak nevezzék, és legyen az elektron a pozitron és a negatron közös neve.
1947-ben Willis Lamb hallgatójával, Robert Retherforddal közösen úgy találta, hogy a hidrogénatom azonos energiájú állapotai egymásból eltolással kaphatók. Ez a Lamb-shift. Ugyanekkor Polykarp Kusch és Henry M. Foley felfedezték, hogy az elektron mágneses momentuma valamivel nagyobb, mint ami Dirac képletéből következik. Ezt a különbséget az elektron anomáliás mágneses dipólusnyomatékának nevezték. Ezt a különbséget a kvantumelektrodinamika magyarázta meg, amit Sin-Itiro Tomonaga, Julian Schwinger és Richard Feynman fejlesztett ki az 1940-es évek végén.[63]
Részecskegyorsítók[szerkesztés]
A részecskegyorsítók fejlődésével és az egyre nagyobb energiák elérésével a fizikusok egyre mélyebben tudták elemezni az elemi részecskék tulajdonságait.[64] Az elektronokat először 1942-ben tudta felgyorsítani Donald Kerst mágneses indukcióval. Betatronjával 2,3 MeV-ot ért el; a későbbi betatronok 300 MeV-ig gyorsították az elektronokat. 1947-ben felfedezték a szinchrotron sugárzást a General Electric 70 MeV-os szinchrotronjában. A sugárzást az elektronok gyorsulása okozta.[65]
Az első részecskeütköztető az ADONE volt, ami 1968-ban kezdte meg működését 1,5 GeV energiájú nyalábokkal.[66] Elektronokat és pozitronokat ütköztetett, amivel megkétszerezte az ütközés energiáját az álló célhoz képest.[67] A CERN ütköztetője, a Large Electron–Positron Collider (LEP) 1989-től 2000-ig működött, 209 GeV ütközési energiát ért el, és fontos méréseket végzett a részecskefizika standard modellje számára.[68][69]
Egyes elektronok befogása[szerkesztés]
Egyes elektronok könnyen elfoghatók kis (L = 20 nm, W = 20 nm) CMOS tranzisztorokkal −269 °C (4 K) és −258 °C (15 K) között.[70] Az elektron hullámfüggvénye félvezető rácsban terjed, és elhanyagolható mértékben reagál a többi elektronnal, úgyhogy egyetlen részecskeként kezelhető, ha tömegét az effektív tömegtenzorral helyettesítik.
Tulajdonságai[szerkesztés]
Osztályozása[szerkesztés]
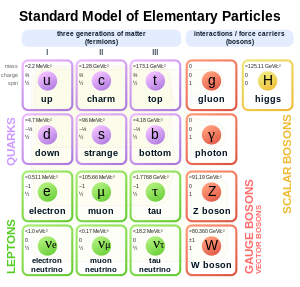
A részecskefizika standard modellje szerint az elektronok a leptonok közé tartoznak, amelyek az elemi részecskék egy csoportja. Az elektromosan töltött leptonok között az elektron a legkönnyebb. Első generációs elemi részecske.[71] A második és a harmadik generáció hasonló elektromosan töltött, de nehezebb részecskéket (müon, tau) tartalmaz. A leptonok abban különböznek a kvarkoktól, hogy nem hat rájuk az erős kölcsönhatás. A leptonok mind fermionok félegész spinjük miatt. Az elektron spinje 1/2 vagy -1/2.[72]
Alapvető tulajdonságai[szerkesztés]
Egy elektron invariáns tömege megközelítőleg 9,109×10−31 kilogramm, vagy 5,489×10−4 atomi tömegegység.[73] Einstein tömeg-energia megfeleltetésével ez 0,511 MeV nyugalmi energiának felel meg. A proton és az elektron tömegének aránya körülbelül 1836.[3][74] A csillagászati mérések azt mutatják, hogy a proton/elektron tömegarány változatlan legalább az Univerzum életének legalább a fele óta, ahogy a standard modell állítja.[75]
Az elektron töltése −1,602×10−19 Coulomb.[73] Ezt elemi töltésegységnek nevezik, és a szubatomi részecskék töltésének mérésére használják. Relatív pontossága 2,2×10−8.[73] Kísérleti pontossággal az elektron töltése ugyanakkora, mint a protoné, de ellenkező előjelű.[76] Az elemi töltést gyakran e-vel jelölik, így az elektron jele e−, ahol a mínusz jel a negatív töltésre utal. Hasonlóan, a pozitron jele e+, mivel minden tulajdonságban egyezik az elektronnal, kivéve ellentétes töltését.[72][73]
Az elektron belső szögmomentuma avagy spinje 1/2.[73] Erre gyakran úgy utalnak röviden, hogy spin-1/2-részecske.[72] Az ilyen részecskék spinjének magnitúdója ħ. Ez azt jelenti, hogy a spin vetülete bármely tengely irányában ±ħ/2. Emellett az elektronnak spintengely irányú mágneses momentuma is van,[73] ami megközelítőleg 1 Bohr magneton.[77] A Bohr magneton:
- Ennek mértéke 9.27400915(23)×10−24 Joule / Tesla.[73] A spin momentum szerinti iránya definiálja a helicitást.[78]
Az elektronnak nincs ismert belső szerkezete.[79][80] A modellek pontszerűnek és ponttöltésnek tekintik, aminek nincs kiterjedése.[2] A klasszikus fizikában egy test szögmomentuma és mágneses momentuma fizikai kiterjedésétől függ. Így a pontszerű elektronmodell ellentmond a Penning-csapdákkal tett megfigyeléseknek, amik véges, de nem nulla sugárra utalnak. Ennek egy lehetséges magyarázatát majd a Virtuális részecskék szakasz adja a Foldy-Wouthuysen transzformáció figyelembe vételével.
Az elektron sugara egy megoldatlan kérdés a modern részecskefizikában. A véges nem nulla sugár nem fér össze a relativitáselmélettel. Másrészt a pontszerű elektron súlyos matematikai problémákat okoz, mivel így az elektron sajátenergiája végtelennek adódik.[81] Mindezeket részletesen elemezte Dmitri Ivanenko és Arseny Sokolov.
A Penning-csapdába befogott elektron mérésével a részecske sugarára 10−22 méter adódik.[82] Létezik egy klasszikus fizikai konstans, ami az elektronsugár néven ismert, ami 2,8179×10−15 m, így nagyobb, mint a protoné. Ez az elnevezés a kvantumfizikai hatásokat figyelmen kívül hagyó számításokból ered. Valójában ennek nem sok köze van az elektron valódi szerkezetéhez.[83]
Vannak elemi részecskék, amik spontán könnyebb részecskékre bomlanak. Erre egy példa a müon, ami elektronra, neutrinóra és antineutrinóra bomlik 2,2×10−6 várható élettartammal. Az elektron stabilitását elméleti indokok magyarázzák: mivel a legkönnyebb részecske, aminek tömege van, ezért bomlása sértené az anyagmegmaradás elvét. Az elektron élettartama legalább 6,6×1028 év, 90%-osd konfidenciával.[84][85][86][87]
Kvantummechanikai tulajdonságai[szerkesztés]
Ahogy minden részecskének, úgy az elektronnak is van hullámtermészete, és megnyilvánulhat hullámként. Ez a hullám-részecske kettősség, és a kétnyílásos kísérlettel mutatható meg. Hullámtermészete miatt az elektron egyszerre mindkét nyíláson áthaladhat, és interferálhat önmagával.
A kvantummechanika a részecskék hullámtermészetét komplex értékű függvénnyel írja le. EZ a hullámfüggvény, amit görög betűvel, ψ-vel jelölnek. Ha ennek abszolútértékét négyzetre emelik, akkor megkapjuk annak a valószínségét, hogy a részecske mely hely közelében milyen valószínűséggel figyelhető meg. Ez a valószínűségi sűrűség.[88]
Az egyes elektronok nem különböztethetők meg egymástól belső fizikai tulajdonságaik alapján. Ez azt jelenti, hogy egy egymással kölcsönható elektronpár két tagja kicserélhető anélkül, hogy észrevehető, mérhető változás történne. A fermionok, köztük az elektronok hullámfüggvénye antiszimmetrikus, ami azt jelenti, hogy a két elektron felcserélésével a függvény előjelet vált. Azaz ψ(r1, r2) = −ψ(r2, r1), ahol az r1 és az r2 változók az elektronokat jelölik. Mivel ezzel nem változott az abszolútérték, ezért a valószínűségek változatlanok maradtak. A bozonok hullámfüggvénye ezzel szemben szimmetrikus.[88]
Antiszimmetrikus esetben a hullámegyenletek megoldása nulla valószínűséget ad arra, hogy a két részecske egyszerre ugyanazt a helyet vagy állapotot foglalja el. Ennek a következménye a Pauli-féle kizárási elv. Ez magyarázza az elektronok viselkedését, például hogy miért kerülnek páronként külön pályára, vagy hogy miért alakulnak ki elektronpárok.[88]
Virtuális részecskék[szerkesztés]
Egyszerűsített kép szerint a fotonok életük egy szakaszát elektron-pozitron párként töltik, amelyek hamarosan megsemmisülnek, és energiájuk fotonná alakul.[89] A párok létrejöttéhez szükségese energia és élettartama Heisenberg-féle határozatlansági relációban áll egymással: ΔE · Δt ≥ ħ. A szükséges ΔE energiát a vákuum is biztosíthatja egy rövid időre. Mivel ħ ≈ 6,6×10-16 eV·s, azért ez elektron esetén többnyire 1,3×10−21 s.[90]
Az elektron erőterében létrejövő elektron-pozitron pár tagjai közül töltése miatt a pozitron vonzódik, míg az elektron taszítást szenved. Ez vákuumpolarizációhoz vezet, ami miatt a vákuum dielektrikus permittivititássá válik. Ez csökkenti az elektron effektív töltését a valódi alá.[91][92] Ezt 1997-ben a japán TRISTAN részecskegyorsítóval végzett kísérletek is megerősítették.[93] A virtuális részecskék hasonlóan árnyékolják az elektron tömegét is.[94]
A virtuális részecskékkel történő kölcsönhatás magyarázza a belső mágneses momentum 0,1%-os eltérését a Bohr-magnetontól. Ez az anomáliás mágneses momentum.[77][95] A kvantum-elektrodinamika egyik legfontosabb eredménye, hogy a megjósolt eltérést mérési eredményekkel is igazolni lehetett.[96]
A virtuális részecskék segítenek megmagyarázni a pontszerű elektron belső szögmomentumát és mágneses momentumát is. A virtuális fotonok hatására az elektron remegő mozgását (zitterbewegung),[97] ami miatt az elektron precessziós körpályán mozog. Ez hozza létre a spint és a mágneses momentumot.[2][98] Az atomokban szintén a virtuális fotonok okozzák a Lambda-eltolódást, ami a színképvonalakon megfigyelhető.[91]
Kölcsönhatások[szerkesztés]
Az elektron negatív töltésű, ezért elektromos erőtere vonzza a pozitív töltésű részecskéket, mint például a protont, és taszítja a negatív töltésűeket. Ennek erősségét a Coulomb-törvényhatározza meg.[99] A mozgó elektron mágneses erőteret indukál.[88] Az Ampère-törvény ennek erősségét az elektron tömegéhez és a megfigyelőhöz viszonyítja. Ez az indukció kelti azt a mágneses erőt, ami meghajt egy elektromos motort. A mozgó töltött részecskék mágneses terét a Liénard–Wiechert-potenciál fejezi ki, ami fénysebesség közeli részecskékre is a helyes eredményt adja.
Ha egy elektron mágneses térben mozog, akkor hat rá a Lorentz-erő. Ez a centripetális erőmerőleges arra a síkra, amit az erőtér és az elektron sebessége határoz meg. Ennek a hatására az elektron csavarpályán kezd mozogni, aminek sugara a gyroradius.[88][100] Az elektron gyorsulása eredményezi a szinkrotronsugárzást. A távozó energia olyan hatással van, mint a súrlódás, vagyis lassítja az elektront. Ez a Abraham–Lorentz–Dirac-erő, ami az elektron saját terének visszahatása az elektronra.[101]
A kvantum-elektrodinamikában a részecskék között a fotonok közvetítik az elektromágneses energiát. Egy állandó sebességű, egyenes vonalon mozgó izolált elektron nem bocsátana ki vagy nyelne el fotont, amivel megsértené az energiamegmaradást és a momentummegmaradást. Ezen újra a virtuális részecskék segítenek. Például a virtuális fotonok Coulomb-erőt közvetítenek.[102] Az elektron energiát ad le, ha egy töltött részecske, például egy proton közelébe kerül. Az elektron gyorsulása fékezési sugárzásteredményez.[103]
Egy szabadon mozgó elektron és egy foton rugalmatlan ütközése a Compton-szórás. Ennek eredményeképpen megváltozik a részecskék momentuma és energiája, így a foton hullámhossza a Compton-eltolással módosul. Ennek nagysága legfeljebb h/mec, amit Compton-hullámhossznak neveznek.[104] Ez elektronra 2,43×10−12 m. Hosszú hullámhosszakon, mint például a látható fény (0,4–0,7 μm) ez az eltolódás elhanyagolható. Ez a kölcsönhatás a Thomson-szórás.[105]
Két töltött részecske közötti elektromágneses kölcsönhatás erősségét a finomszerkezeti állandó adja meg. Ezt a mértékegység nélküli mennyiséget a vonzás vagy taszítás elektrosztatikus energiája egy Compton-hullámhosszon, és a nyugalmi energia hányadosa adja meg. Mennyisége α ≈ 7,297353×10−3, ami megközelítőleg .[73]
Ha elektron és pozitron találkozik, akkor szétsugárzódnak két vagy több gamma-foton formájában. Ha momentumuk elhanyagolható, akkor a szétsugárzódás előtt pozitróniumatom alakulhat ki, és a szétsugárzódás összenergiája 1,022 MeV.[106][107] Másrészt, a nagy energiájú fotonok töltött részecskék közelében elektron-pozitron párrá alakulhatnak; ez a párreprodukció.[108][109]
Az elektrogyenge kölcsönhatások elméletében az elektron hullámfüggvényének bal oldali komponense gyenge izospin komponenst alkot az elektronneutrinókkal. Ez azt jelenti, hogy a gyenge kölcsönhatásokban az elektronneutrinó ugyanúgy viselkedik, mint az elektron. A kettős bármelyik tagja töltött áramú kölcsönhatásba léphet, és egy W kibocsátásával vagy elnyelésével a kettős egy másik tagjává válhat. A töltés megmarad, mert a W-bozonnak is van töltése. A töltött áramú kölcsönhatás eredményezi a radioaktív bomlásban a béta-bomlást. Az elektron és az elektronneutrinó is kerülhet semleges áramú kölcsönhatásba, ami egy Z0 cseréjével jár, és ez okozza a neutrinó-elektron rugalmas szórást.[110]
Atomok, ionok, molekulák[szerkesztés]
Az elektron Coulomb-erővel kapcsolódhat egy pozitív töltésű atommaghoz. Az atommag a rendszámának megfelelő számú elektron megkötésével atommá válik. Ha az elektronok száma ennél több vagy kevesebb, akkor ion jön létre. Az atomban vagy ionban levő elektron hullámszerű viselkedését az atompályák írják le. Minden pályát más-más kvantumszámok jellemeznek, és csak a megfelelően megadott kvantumszámok határoznak meg pályát. A Pauli-féle kizárási elv miatt minden pályán két elektron lehetséges, amelyek azonban különböznek a spin kvantumszámukban.
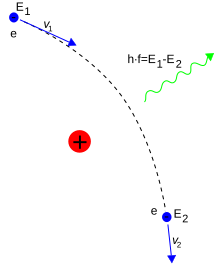
Az elektronok fotonok elnyelésével vagy kibocsátásával válthatnak pályát. A foton energiája megegyezik a két pálya energiájának különbségével.[111] A pálya más részecskékkel való ütközés is megváltoztathatja. Az Auger-effektus miatt is módosulhat a pálya.[112] Az atomtól való elszakadáshoz az elektronnak akkora energiára kell szert tennie, amennyi eléri vagy meghaladja a kötési energiát. Ez is bekövetkezhet fotonok hatására; ez a fotoelektromos hatás.[113]
Az elektronok pálya menti szögmomentuma kvantált. Töltése miatt az elektron pálya menti mágneses momentuma arányos a szögmomentummal. Az atom mágneses momentuma egyenlő a mag és az elektronok pálya menti és spin mágneses momentumainak vektorösszegével. Az elektronpárok mágneses momentuma ellentettje egymásnak, ezért kiegyenlítik egymást.[114]
Az atomok közötti kémiai kötések elektromágneses kölcsönhatások eredményei, amit a kvantummechanika törvényei írnak le.[115] A legerősebb kötéseket az elektronok átadása vagy megosztása hozza létre. Az első ionokat, a második molekulákat hoz létre.[4] Több atommag vonzása alá kerülve az elektronok molekulapályán mozognak.[116] A molekulák kialakulásában döntő tényező az elektronpárok létezése. Ezek ellentétes spinű elektronok, amelyek a Pauli-féle kizárási elv szerint is közös pályán lehetnek. A különböző molekulapályák eltérően hatnak az elektronsűrűség térbeli eloszlására. A kötő elektronpárok többnyire a két atom között fordulnak elő, míg a nem kötő elektronpároknak nagyobb hely jut az atomok körül.[117]
Vezetés[szerkesztés]
Ha egy testnek több, vagy kevesebb elektronja van, mint amennyi a semleges lenne, akkor a test elektromosan töltött. A test elektromosan semleges, ha benne az elektronok száma megegyezik a protonok számával. Ha több elektronja van, akkor negatív, ha kevesebb, akkor pozitív töltése van. A makroszkopikus testek elektromos töltést nyerhetnek dörzsölés által, ez a dörzselektromosság.[121]
A vákuumban függetlenül mozgó elektronokat szabad elektronoknak nevezik. A fémes kötésben részt vevő közös elektronok úgy viselkednek, mintha szabadok lennének. A különböző szilárd közegekben mozgó töltéshordozó részecskéket kvázielektronoknaknevezik, mivel tömegük különbözhet az elektronoktól.[122] Ha a szabadnak tekinthető elektronok együtt mozognak, akkor hálózati folyamot, áramot hoznak létre, ami mágneses teret indukál. Hasonlóan, változó mágneses tér áramot indít el. Ezeket a kölcsönhatásokat matematikailag a Maxwell-egyenletek írják le.[123]
Hőmérséklettől függően minden anyagnak van kisebb-nagyobb elektromos vezetőképessége. A jó vezetők közé tartozik a legtöbb fém, mint az ezüst, az arany és a réz, míg az üveg és a teflon rosszul vezeti az elektromosságot. A dielektromos anyagokban az elektronok szilárdan kötődnek az atomokhoz és a molekulákhoz, ezért ezek elektromos szigetelőként viselkednek. A legtöbb félvezetővezetőképessége szabályozható a jó vezető és a jó szigetelő között.[124] Másrészt a fémek elektronikus sávszerkezete csak részben töltött sávokból áll. A sávok teszik lehetővé a delokalizált elektronok szabad mozgását. Mivel ezek sok atomhoz tartoznak, így szabadon mozoghatnak, mint egy gáz molekulái vagy atomjai.[125]
Az elektronok és az atommagok közötti ütközések miatt az elektronok sodródási sebessége néhány milliméter másodpercenként. Ezzel szemben az anyagban a változások tipikusan a fénysebesség 75%-ával terjednek.[126] Ez azért lehetséges, mert az elektromos jelek hullámként terjednek, és sebességük az anyag dielektromos állandójától függ.[127]
A legtöbb fém a hőt is jól vezeti a delokalizált elektronoknak köszönhetően. Hővezetésük, szemben az elektromos vezetéssel, független a hőmérséklettől, amit a Wiedemann–Franz-törvény fejez ki:[125] a hővezetés és az elektromos vezetés aránya egyenesen arányos a hőmérséklettel. Minél melegebb a fémdarab, annál több benne a rácshiba, ami akadályozza az elektromos vezetést, azaz növeli az ellenállást.[128]
Egy bizonyos hőmérséklet alá hűtve az anyagok ellenállása eltűnik, és az anyag szupravezetővé válik. A BCS-elmélet szerint ennek az az oka, hogy az elektronpárok a Bose–Einstein-kondenzáció kvantumállapotába kerülnek. Ezek a Cooper-párok a fononoknak nevezett rácsvibrációk mentén haladnak, így elkerülik az ütközéseket, ami ellenállást eredményez. A Cooper-párok sugara 100 nm, átfedhetik egymást.[129] (Cooper pairs have a radius of roughly 100 nm, so they can overlap each other.)[130] Ezzel szemben a magas hőmérsékletű szupravezetők működése megmagyarázatlan.
Az abszolút nulla fok közelében az elektron, mint kvázirészecske úgy viselkedik, mintha három részből állna: spinonra, orbitonra és holonra hasad.[131][132] Az első hordozza a spint, a második a helyet, a harmadik a töltést.
Mozgás és energia[szerkesztés]
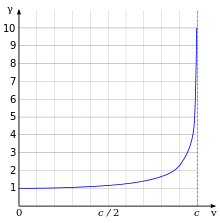
Einstein speciális relativitáselmélete szerint, ha egy elektron sebessége megközelíti a fényét, akkor a megfigyelő szempontjából megnő a relativisztikus tömege, és nehezebb lesz gyorsítani. Az elektron sebessége megközelítheti a vákuumbeli fénysebességet, de nem érheti el. Dielektromos közegbe, például vízbe érve egy ideig a relativisztikus sebességű elektron gyorsabban haladhat a közegbeli fénysebességnél. A közeggel kölcsönhatva Cserenkov-sugárzást bocsát ki.[133]
A speciális relativitáselmélet hatásainak alapja a Lorentz-tényező, aminek képlete
ahol c a fénysebesség, v a részecske sebessége. A v sebességgel mozgó elektron Ke mozgási energiája:
- , ahol me az elektron tömege. Például, a Stanford lineáris gyorsító az elektront 51 GeV-ra.[134] Hullámtermészetemiatt az elektronnak de Broglie-hullámhossza is van. Ennek képlete λe = h/p, ahol h a Planck-konstans, és p a momentum.[55] Például az 51 GeV energiához tartozó hullámhossz 2,4×10−17 m, ami elég kicsi ahhoz, hogy az atommagnál sokkal kisebb szerkezetek is vizsgálhatók legyenek.[135]
Keletkezése[szerkesztés]
A nagy bumm elmélet a legelfogadottabb tudományos elmélet az Univerzum keletkezésére.[136] Az első millimásodpercben a hőmérséklet 10 milliárd Kelvin fölött volt, és a fotonok átlagos energiája meghaladta a millió elektronvoltot. Ez elég volt ahhoz, hogy elektron-pozitron párokat hozzanak létre. A fotonok, elektronok és pozitronok egyensúlya jellemezte az Univerzumot 15 másodpercig. Ezután annyira lehűlt, hogy nem tudott több elektron-pozitron pár létrejönni. A legtöbb pár összetalálkozva szétsugárzódott, ami egy időre újra felmelegítette az Univerzumot.[137]
Ismeretlen okokból a leptogenezis folyamán valamivel több elektron jött létre, mint pozitron.[138] Így minden milliárdból egy elektron élte túl a szétsugárzódást. Ugyanez volt a hatás a bariogenezisre is, így ugyanannyi proton maradt, mint elektron, ezzel az Univerzum töltésösszege nulla lett.[139][140] A megmaradt protonokból és neutronokból nukleoszintézissel a hidrogén, a hélium és nyomokban a lítium izotópjainak magjai jöttek létre. Ez 5 perccel az Univerzum keletkezése után érte el csúcsát.[141] A kimaradt neutronok 1000 másodperces felezési idővel elbomlottak:
- n → p + e− + νe
A következő 300000–400000 évben a fölös elektronok túl nagy energiával bírtak ahhoz, hogy atomok részeivé váljanak.[142] Ezután jött el a rekombináció ideje, amikor semleges atomok jöttek létre, és a táguló Univerzum áthatolhatóvá vált a sugárzások számára.[143]
A nagy bumm után 1 millió évvel kezdődött a csillagok keletkezése. A csillagokban zajló nukleoszintézis neutronokat és pozitronokat termel. A pozitronok fogyasztják az elektronokat. Ezzel szemben a nukleoszintézis radioaktív magokat is létrehoz, amelyek egy része béta-bomlással bomlik, és elektront és antineutrinót bocsátanak ki.[144] Erre példa a kobalt-60, ami béta-bomlással nikkel-60-ná alakul.[145]
A 20 naptömegnél nehezebb csillagok magja a külső rétegeket ledobva életük végén magába roskad, és fekete lyukat hoz létre.[146] A klasszikus fizika szerint semmi, még elektromágneses sugárzás sem juthat ki belőle. A kyantummechanika szerint azonban a Hawking-sugárzás érkezhet az eseményhorizont mögül. Ennek a hatására szintén keletkezhetnek elektronok és pozitronok.
A Hawking-sugárzás mechanizmusa a következő: A fekete lyuk eseményhorizontja közelében virtuális részecskék jönnek létre. A fekete lyuk gravitációs potenciálja pozitív energiát juttat a pár egyik tagjának, és az valódi részecskévé válik,[147] míg a másik tagja negatív energiához jut, és csökkenti a fekete lyuk energiáját, így az lassanként párolog. A Hawking-sugárzás a csökkenéssel együtt erősödik, míg végül a fekete lyuk felrobban.[148]
A kozmikus sugarak nagy energiájú részecskékből állnak. Megfigyeltek már 3,0×1020 eV energiájú részecskéket is.[149] Ha ezek a Föld légkörének nukleonjaival találkoznak, akkor részecskezáport indítanak el, amiben többek között pionok is keletkeznek.[150] Az esetek többségében müonok érkeznek. A müonok a pionok bomlásának termékei:
- π− → μ− + νμ
A müon bomlása pedig elektront vagy pozitront termel:[151]
- μ− → e− + νe + νμ
Megfigyelése[szerkesztés]
A távoli elektronok jelenlétét az általuk kisugárzott sugárzás jelzi. Például a nagy energiájú helyeken, mint a csillagok koronájában az elektronok plazmát alkotnak; innen fékezési sugárzás érkezhet. Az elektrongázban plazmaoszcilláció is kialakulhat; ezt a hullámot a szinkronban változó elektronsűrűség hozza létre, és rádióteleszkóppalmegfigyelhető.[153]
A foton energiája frekvenciájával arányos. Amikor egy elektron pályát vált egy atomban, akkor bizonyos frekvenciájú fotonokat nyel el vagy bocsát ki. Például, ha az atomokon széles spektrumú fény hatol át, akkor bizonyos frekvenciák kiszűrődnek, az áthatolás után a spektrumban fekete elnyelési vonalak jelennek meg. Minden elemnek megvannak a saját elnyelési vonalai. Emiatt spektroszkóposelemzéssel az egyes összetevők kimutathatók.[154][155]
Laboratóriumi körülmények között az egyes elektronok kölcsönhatásai részecskedetektorokkal figyelhetők meg, amelyekkel mérni lehet az energiát, a spint és a töltést. A Paul-csapda és a Penning-csapda lehetővé teszi töltött részecskék hosszabb ideig tartó tárolását kis helyen. Ezek segítségével a részecskék tulajdonságai jól mérhetők. Például egyetlen elektront 10 hónapig tároltak Penning-csapdában.[156] Az elektron mágneses momentumát 11 tizedesjegy pontossággal tudták megmérni, ami 1980-ban meghaladta a többi ismert fizikai állandó pontosságát.[157]
Az elektron energiaeloszlásának változását először a Lund Egyetemen (Svédország) filmezték le 2008 februárjában. A kutatók attoszekundumos fényvillanásokat használtak, így elsőként figyelhették meg egy elektron mozgását.[158][159]
Az elektronok eloszlása szilárd anyagokban az angle-resolved photoemission spectroscopy (ARPES) technikájával vizsgálható. Fotoelektromos hatást használ a reciprok térmérésére, ami a periodikus szerkezetek egy matematikai reprezentációja, és amiből vissza lehet következtetni az eredeti szerkezetre. Meghatározható a sebesség, az irány és a szóródás.[160]
Plazma alkalmazások[szerkesztés]
Részecskesugarak[szerkesztés]
Az elektrongáz áramlását felhasználják hegesztéshez.[161] Ez megengedi a 107 W·cm−2 energiasűrűséget. A fókusz átmérője 0,1–1,3 mm, és nem igényel töltőanyagot. Ez a hegesztés vákuumot igényel, hogy az elektronok ne lépjenek kölcsönhatásba a gázzal, mielőtt elérik a célt. Ezzel olyan vezető anyagokat is összekapcsolnak, amiket nem lehetne hagyományos módon összehegeszteni.[162][163]
Az elektronsugaras litográfia (EBL) félvezetőket dolgoz fel egy mikrométernél nagyobb pontossággal.[164] Hátránya a lassúsága és a költsége. Az elektronsugarat vákuumban kell létrehozni. Az elektronok szóródása a szilárd anyagokon 10 nm-re korlátozza a pontosságot. Emiatt csak kevés speciális integrált áramkörhöz használják a módszert.[165]
Az elektrongázas besugárzást használják élelmiszerek és gyógyszerek sterilizálására, valamint anyagok tulajdonságainak megváltoztatására.[166] Nagyságrendekkel csökkentheti például az üvegek viszkozitását melegítés nélkül és az aktivációs energiát.[167]
A lineáris részecskegyorsítók által kisugárzott elektronsugarakkal felszíni daganatokat kezelnek. Az elektronterápiával azért kezelhetők bőrsérülések és a bazális sejt karciómák, mert nem hatol mélyre, tipikusan 5 cm a távolság 5-20 MeV energia esetén. Kiegészítésként használják a röntgenes besugárzás után.[168][169]
A részecskegyorsítók által kiadott szinkrotronsugárzást a részecskefizikában alkalmazzák. Ez polarizálja az elektronsugarat, ami Szokolov–Ternov-hatásként ismert. A polarizált elektronsugarakkal különféle kísérleteket végeznek. A szinkrotronsugárzás az elektronok lassítására is használható. Az elektronok és pozitronok ütköztetése energiát hoz létre, amit szintén tanulmányoznak.[170]
Képalkotás[szerkesztés]
A kis energiájú elektron diffrakció (LEED) egy módszer, amiben kristályos anyagokat bombáznak elektronsugarakkal, és a keletkezett diffrakciós mintázatból következtetnek az anyag szerkezetére. Itt az elektronok energiája tipikusan 20–200 eV.[171] A tükrözéses nagy energiájú diffrakció (RHEED) a felszínt vizsgálja. Különböző szögekből irányítják a tárgyra a sugarakat. Az elektronsugár energiája 8–20 keV, és a szög 1–4°.[172][173]
Az elektronmikroszkóp fókuszált elektronsugarakat bocsát a tárgyra. Egyes elektronoknak megváltozik a mozgásiránya, szöge, a fázisa és az energiája, miután a sugár betalált a tárgyba. Ezek alapján megalkotható a tárgy atomnyi felbontású képe.[174] Az optikai mikroszkópokban a kék fény használatával 200 nm-es felbontás érhető el.[175] Az elektronmikroszkóp felbontóképességét az elektron hullámhossza határozza meg, ami 100 ezer voltos feszültségen 0,0037 nm.[176] A Transmission Electron Aberration-Corrected Microscope képes 0,05 nm-nél nagyobb pontosságra, ami több mint elég ahhoz, hogy egyes atomokat láthatóvá tegyen.[177] Ezzel az elektronmikroszkóp hasznos képalkotó segédeszköz a laboratóriumok számára. Azonban az elektronmikroszkópot nem sok hely engedheti meg magának, mivel drága, és karbantartása is sokba kerül.
Az elektronmikroszkópnak két fő típusa létezik: a transzmissziós és a pásztázó. A transzmisszós elektronmikroszkóp átküldi a sugarat a tárgyon, és az áthaladt elektronokat lencsével rávetítik a képalkotó felületre. A pásztázó elektronmikroszkópok a tárgy felszínét vizsgálják. Mindkét típus nagyítása terjedhet százszorostól egymilliószorosig, vagy akár még tovább. A pásztázó csatornázó elektronmikroszkóp kvantumcsatornázásával juttatja az elektronokat a hegyes fémvégről a tárgyra, és úgy alkot atomnyi felbontású képeket a felszínről.[178][179][180]
Más alkalmazások[szerkesztés]
A szabad elektronos lézerben (FEL) relativisztikus elektronsugár halad át egy dipólmágnesekből álló rácson, amiben a mágnesek azonos polaritással néznek egymás felé. Az elektronok szinkrotronsugárzást bocsátanak ki, ami koherensen kölcsönhat az elektronokkal, így felerősíti a sugárzás mezőjét a rezonancia frekvenciáján. A FEL különböző frekvencián képes koherens elektronsugárt kibocsátani, a mikrohullámoktól a lágy röntgensugarakig. Használják az iparban, a kommunikációban és a gyógyításban.[181]
A katódsugárcsöveket széles körben használják, megtalálhatók laboratóriumi berendezésekben, tévékészülékekben és képernyőkben.[182] A fénysokszorozó csövekben a fotókatódhoz érkező fotonok elektronlavinát indítanak el, ami detektálható áramlökést produkál. A vákuumcsövekben vezetett elektronsugarak elektromos jeleket közvetítenek, ezzel kritikus szerephez jutnak az elektrotechnikában. Azonban komoly vetélytársat jelentenek számukra a szilárd anyagú eszközök, például tranzisztorok.



 ħ. Ez azt jelenti, hogy a spin vetülete bármely tengely irányában ±ħ/2. Emellett az elektronnak spintengely irányú mágneses momentuma is van,
ħ. Ez azt jelenti, hogy a spin vetülete bármely tengely irányában ±ħ/2. Emellett az elektronnak spintengely irányú mágneses momentuma is van, Ennek mértéke 9.27400915(23)×10−24 Joule / Tesla.
Ennek mértéke 9.27400915(23)×10−24 Joule / Tesla.


 .
.


 , ahol me az elektron tömege. Például, a
, ahol me az elektron tömege. Például, a 


Nincsenek megjegyzések:
Megjegyzés küldése